Að mynda sameindir efnasambönd, frumeindir mismunandi efna eða frumefna verða að sameina sig á stöðugan hátt, og þetta getur komið fram á ýmsa vegu í krafti uppbyggingareiginleikanna sem hvert atóm hefur, sem eins og við vitum samanstendur af jákvætt hlaðnum kjarna umkringdur rafeindaskýi.
Rafeindirnar eru neikvætt hlaðnar og haldast nálægt kjarnanum vegna þess að rafsegulkraftur laðar þá. Því nær sem rafeind er kjarnanum, því meiri orka sem þarf til að fá hann til að losna.
En ekki eru allir þættir eins: sumir hafa tilhneigingu til að missa ystu rafeindir skýsins (frumefni með litla jónunarorku) en aðrir hafa tilhneigingu til að fanga þær (frumefni með mikla rafeindasækni). Þetta gerist vegna þess samkvæmt Lewis áttunda reglu, tengist stöðugleiki nærveru 8 rafeinda í ystu skel eða hringbraut, að minnsta kosti í flestum tilfellum.
Þá hvernig það getur verið tap eða ávinningur af rafeindumgeta myndast jónir með gagnstæðri hleðslu og rafstöðueiginleikinn milli jóna gagnstæðu hleðslunnar veldur því að þeir sameinast og mynda einföld efnasambönd, þar sem eitt frumefnanna gaf upp rafeindir og hitt tók á móti þeim. Svo að þetta geti gerst og a jónatengi það er nauðsynlegt að það sé munur eða delta á rafeindatölu milli þáttanna sem taka þátt, að minnsta kosti 1,7.
The jónatengi kemur oftast fram milli málmsambands og málms sem ekki er málmur: málmsatómið gefur frá sér eina eða fleiri rafeindir og myndar þar af leiðandi jákvætt hlaðnar jónir (katjónir) og ómálmið fær þá og verður neikvætt hlaða agnið (anjón ). Alkalímálmarnir og jarðalkalímálmarnir eru þau frumefni sem hafa mest tilhneigingu til að mynda katjónir og halógen og súrefni eru venjulega anjónin.
Eins og venjulega, efnasambönd sem myndast við jónatengi eru fast efni við stofuhita og hátt bræðslumark, leysanlegt í vatni. Í lausn eru þeir mjög góðir leiðarar rafmagnsþar sem þeir eru sterkir raflausnar. Grindorka jónaefnis er það sem markar aðdráttaraflið á milli jóna þess efnis.
Það getur þjónað þér:
- Dæmi um samgild skuldabréf
- Magnesíumoxíð (MgO)
- Koparsúlfat (CuSO4)
- Kalíum joðíð (KI)
- Sinkhýdroxíð (Zn (OH) 2)
- Natríumklóríð (NaCl)
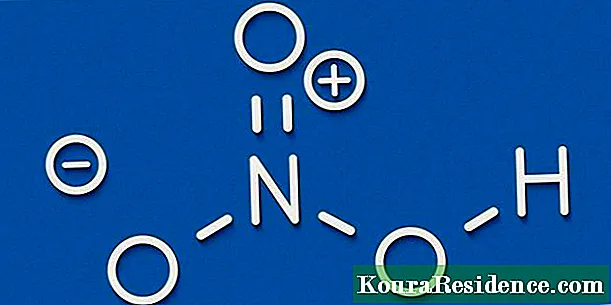
- Silfur nítrat (AgNO3)
- Lithium fluoride (LiF)
- Magnesíumklóríð (MgCl2)
- Kalíumhýdroxíð (KOH)
- Kalsíumnítrat (Ca (NO3) 2)
- Kalsíumfosfat (Ca3 (PO4) 2)
- Kalíumdíkrómat (K2Cr2O7)
- Tvínatríumfosfat (Na2HPO4)
- Járnsúlfíð (Fe2S3)
- Kalíumbrómíð (KBr)
- Kalsíumkarbónat (CaCO3)
- Natríumhýpóklórít (NaClO)
- Kalíumsúlfat (K2SO4)
- Manganklóríð (MnCl2)